Metil-alkohol a borban
Összefoglalás
Az alábbi cikkben a borok metil-alkohol koncentrációjára vonatkozó ismereteket fogalmaztuk újra. A napjainkban kétség kívül hatást gyakorló klímaváltozás feltételezte a szőlő, mint gyümölcs összetételének megváltozását, melyben a pektin koncentráció esetleges változásaiból adódóan a végtermék metil-alkohol koncentrációja is változhatott. Ebből a célból kifolyólag számos borminta metanol koncentrációját határoztuk meg, kísérleteket folytattunk arra vonatkozólag, hogy csökkenthető-e az egyébként természetes úton meglévő vegyület koncentrációja. Megállapítottuk, hogy nincs jelentős metil-alkohol koncentráció növekedés a magyar borok esetében. Egészségügyi szempontból a borok pozitív megítélését tekintve kívánatos lenne az egyébként nem mérgező koncentrációjú metanol mennyiség csökkentése. Egyelőre a lehetséges technológiai beavatkozásokkal (poligalakturonáz) nem értünk el pozitív eredményeket, ezért további vizsgálatok elvégzése szükséges.
Kulcsszavak: metil-alkohol, GC, poligalakturonáz
Bevezetés
A bor összetevői többnyire pozitív élettani hatással rendelkeznek. Az egyik, természetes úton keletkező, nem kívánatos komponens a metanol, még akkor is ha az eddigiek alapján koncentrációja a kultúrált borfogyasztást feltételezve nem mérgező hatású. Akár marketing célt is szolgálhat ha a technológia alakításával mennyiségét csökkenteni tudjuk. Az elméleti feltételezéseket követve alábbi közleményünkben a jelenleg hozzáférhető legtisztább poligalaktáz aktivitással rendelkező pektinbontó enzimeket vizsgáltuk a technológia során alkalmazva a metanol koncentrációjának alakulása szempontjából.
Abból indultunk ki, hogy amennyiben a galaktáz enzimaktivitást eltoljuk a pektin-metil-észteráz rovására a képződött metanol koncentráció alacsonyabb lesz. Annak ellenére (lásd az előzőek), hogy a tudomány mai állása szerint a pektinbontás első lépése a pektin-metil-észteráz hatására bekövetkező demetoxilálódás. Magyarán a szőlőfeldolgozás legelső fázisában ahogy ez egyébként is lenni szokott a jelenleg hozzáférhető legtisztább poligalakturonáz enzimet használjuk az egyébként is ajánlott koncentrációban annak érdekében, hogy az alapanyagból származó pektin-metil-észteráz aktivitást visszaszorítsuk.
Vizsgálatunkban gázkromatográfia segítségével megmértük a borok metil-alkohol tartalmát, majd következtetéseket vonunk le arra vonatkozóan, hogy a pektolitikus enzimkészítmény milyen hatással volt a borok metil-alkohol koncentrációjának alakulására.
IRODALMI ÁTTEKINTÉS
A metanol (CH3OH), más néven: metil-alkohol; karbinol; faszesz; hidroximetán; fizikai megjelenésében színtelen, jellegzetes szagú folyadék. Olvadáspontja –98 °C, forráspontja +64,7 °C, vízzel és etil-alkohollal korlátlanul elegyedik.
A metanol nem fermentációs melléktermék. A pektinek enzimatikus lebontásából keletkezik a pektinészterázok hatására. Ezért a metanoltartalom közvetlenül összefügg az alapanyag pektintartalmával (Bekatorou, 2016).
A metanol enzimatikus úton történő képződésének alapvető feltétele a savas közeg, mint a gyümölcslevek vagy a bor.
Az erjesztett italok metanoltartalma összekapcsolható a pektinázt termelő élesztők, gombák és baktériumok aktivitásával (Elijah Ige Ohimain, 2016).
A pektinek a heterogén poliszacharidok csoportjába tartozó, általában 25 000-100 000 Dalton molekulatömegű vegyületek, amelyek a legtöbb gyümölcs és zöldség sejtközötti régióiban és sejtfalaiban találhatók a legnagyobb mennyiségben citrusfélékben, különösen narancsban, szőlőben, lime-ban és citromban (Siragusa et al., 1988). Az érés során a gyümölcsökben lévő pektint a pektin-metil-észteráz (PME) lebontja, így metanol képződik (Chaiyasut et al. 2013; Micheli, 2001). Ezenkívül természetesen magas pektintartalommal rendelkeznek az alma, körte, birsalma stb.
A pektin alapvetően olyan galakturonsav polimer (pektinsav), amiben a karboxilcsoportok egy részét vagy mindet metanol észteresíti. Tehát a pektin poli-galakturonsav-metil-észter. A szőlő pektinje általában kevésbé metilészterezett, mint az egyéb gyümölcsök például az almatermésű csonthéjasok, ennek ellenére képződik az előzőekben említett metanol koncentráció.
A pektin-észteráz vagy pektin-metil-észteráz a pektinláncok metilezett csoportjairól szakítja le a metil csoportot. Ez a pektinbontás első lépése, mert a poligalakturonáz enzim csak a metil csoportok leszakítása után tud csatlakozni és továbbhaladni a pektinláncon. Tehát a pektin-észteráz enzim, ha úgy tetszik kötelező tartozéka a pektinázoknak. Ahhoz, hogy a pektint hatékonyan le tudjuk bontani legalább 6 különböző enzimre van szükség. Ezek: pektin-észteráz; poligalakturonáz; pektin-liáz; arabinogalaktanáz; ramnogalakturonáz; arabanáz.
A felszabaduló metanol a direkttermő fajtáknál, az almából, körtéből, birsalmából, stb. készült termékeknél jelenthet gondot, ahol a pektin erősen metilezett és ennél fogva a pektináz aktivitás szignifikáns mennyiségű metanolt szabadíthat fel (Internet).
A pektolitikus enzimek széles körben elterjedtek a természetben, élesztő, baktériumok, gombák és növények termelik őket (Sieiro et al. 2012). A metanol a mikroorganizmusok pektin-metabolizmusának egyik fő végterméke (Schink és Zeikus, 1980). Az emberi vastagbélbaktériumok közül az Erwinia carotovora képes lebontani a pektint, felszabadítva a metanolt (Siragusa et al., 1988). Dorokhov et al. (2015) legalább 20 olyan emberi vastagbél-mikroba fajt soroltak fel, amelyek képesek endogén metanol-termelésre.
A pektolitikus enzimeket észteráz és depolimeráz aktivitásuk szerint csoportosítják (liázok és hidrolázok). A pektin liázokkal történő hidrolízise oligo- vagy mono-galakturonátot eredményez, míg a pektin észterázokkal végzett hidrolízise pektinsavat és metanolt eredményez (Sieiro et al., 2012).
Manapság egyre több exogén enzimet használnak a bor mennyiségének és minőségének javítására. A külső enzimeket a sajtolás szakaszában adják a szőlőlevekhez, mustokhoz és borokhoz, azzal a céllal, hogy növeljék a léhozamot, meggyorsítsák a must és a bor tisztulását, módosítsák az italok aroma-összetételét és organoleptikus tulajdonságait, továbbá megrövidítik a kezelési időket.
Az exogén pektináz enzimek használata engedélyezett a borászatban, legalábbis a következő országokban: Ausztrália, Kanada, az Európai Unió 28 tagállamában, Japánban, Georgia Köztársaságban, Új-Zélandon, Dél-Afrikában és az Egyesült Államok Államokban. (Hodson et al. 2017).
A borászati enzimek Európai Unióban történő felhasználását a Nemzetközi Szőlészeti és Borászati Szervezet szabályozza (OIV), amely kimondja, hogy jelenleg Aspergillus niger és a Trichoderma sp. mikroorganizmus fajok által termelt pektinázok használhatók (Mojsov et al., 2015).
A borok mindig tartalmaznak metil-alkoholt 20–350 mg/l mennyiségben. Ez a kis mennyiség a szőlő pektinjeinek (oldható pektinek és protopektinek) a szőlő pektináz enzimaktivitásának köszönhetően alakul ki. A szőlő szilárd részei mindig több pektint tartalmaznak, mint a bogyóhús, ezért a törkölyön erjesztett borok, a vörösborok több metil-alkoholt tartalmaznak, mint a nem törkölyön erjesztettek. Természetesen a fajták szerint is van különbség a borok metil-alkohol-tartalmában. A direkttermő borokban általában több a metil-alkohol, mint az európai szőlőkből származókban (Kállay, 2010). Továbbá a direkttermő szőlők nem csak a héjban, hanem a húsban is jelentős mennyiségben tartalmaznak pektint.
Hasonlóan a szőlőben természetesen előforduló pektinázok tevékenységéhez, az exogén pektinázok borászati gyakorlatban való használatakor is a borok metanol szintjének emelkedése tapasztalható (Hodson et al. 2017).
Jellemző metanolkoncentráció a borokban
Nagyszámú hazai vizsgálat alapján a borok metil-alkohol-tartalma 21–293 mg/l között volt. Fehérborokban 21–117, siller- és vörösborokban 40–160, direkttermő (Noah, Elvira, Seibel-hidbridek) borokban 40–293 mg/l metil-alkohol található (Kállay, 2010). A Botrytis cinerea nemesrothadáson átment szőlőből készült borok (késői szüretelésű borok, mint pl. Sauternes vagy Tokaj) szintén magasabb metanolszinttel rendelkeznek, mint a szokásos szőlőből készült borok (akár 350-400 mg/l is lehet) (Zoecklein, 1995).
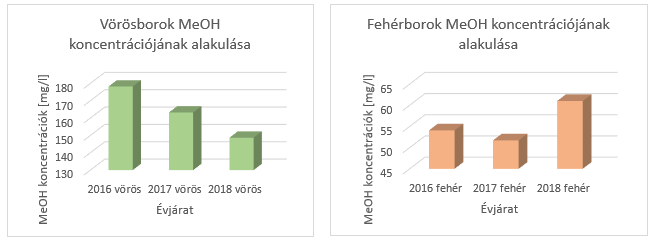
Egyéb kutatási témára irányuló vizsgálataink során megmértük az elmúlt három évjárat vörös- és fehérborainak metil-alkohol koncentrációit, melynek eredményeit az 1. és 2. ábrán szemléltettük. A 2016, 2017 és 2018-as évjáratokból származó 1508 darab vörösborban mért átlagos metil-alkohol koncentráció 181,5 mg/l lett, míg 1317 darab fehérborban az átlagérték 131,5 mg/l. Ennek az általunk elvégezett mérésnek az eredménye is megerősíti azt az állítást, mely szerint a vörösborokban magasabb koncentrációban van jelen a metanol, mint a fehérborokban.
A metanol mérgező vegyi anyag. Az akut metanol mérgezési tünetek hasonlítanak a közönséges alkoholmérgezés tüneteire: hasi fájdalom, látászavar, enyhe központi idegrendszeri depresszió, súlyos esetben gyógyíthatatlan vakság és elhúzódó kóma, légzési elégtelenség következtében bekövetkező halál is előfordulhat. A halálos dózis változó, általában 100-200 ml metanol.
A metanol toxicitása viszonylag alacsony. Lal és munkatársai (2001) szerint már 10 ml metanol bevitele tartós vakságot okozhat, 30 ml pedig végzetes lehet.
Paine és Davan (2001) arról számoltak be, hogy a felnőttek napi biztonságos metanol adagja 2 g, a toxikus dózis pedig 8 g. Ez azt jelenti egy 70 kg-os ember esetében, hogy 1400 mg-ot kellene egyszerre elfogyasztania. Ahhoz, hogy ekkora mennyiségű metil-alkoholt vigyen be a szervezetébe az egyén borból (melynek 400 mg/l a metanol tartalma- a legnagyobb az OIV által javasolt vörösborok metanol határértéke), 3,5 litert kellene egyszerre elfogyasztania, ami majdnem öt 750 ml-es palackot jelent (Hodson et al., 2017).
Egy liter bor metil-alkohol-tartalma a maximális esetben is csak 0,3 g körül van, tehát jóval a veszélyes határ alatt, mégis kívánatos, hogy a borok metil-alkohol-tartalma minél kisebb legyen (Kállay, 2010).
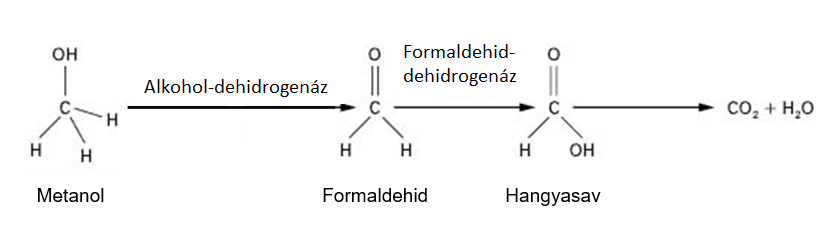
A metanolt az alkohol-dehidrogenáz formaldehiddé oxidálja, majd a formaldehidet a formaldehid-dehidrogenáz enzim oxidálja hangyasavvá (Barceloux et al., 2002). A folyamatot a 3. ábra mutatja.
Az alkohol lebontása a májban történik, ami többféle úton haladhat, de alapvetően három lépésben, acetaldehiden és ecetsavon keresztül végül KoA és ATP felhasználásával acetil-KoA és pirofoszfát keletkezik. A reakciót az acetil-KoA-szintetáz enzim katalizálja.
A metanol erősen mérgező, mert a szervezetben formaldehiddé alakul, ami pedig a legagresszívebb szabad gyök, komoly sejtméreg. A metanol mérgező hatása annak tudható be, hogy a szervezetben nem található meg a formil-koenzim-A nevű enzim, ami a formaldehidet lebontaná úgy, mint az actealdehidet az acetil-koenzim-A, ezért a metanol mérgező marad.
Tyihák Ernő és mtsai. megállapították, hogy a transz-rezveratrol kettős hatást ad, melynek első lépése a formaldehid molekulák felvétele az adott rendszerből, s ez önmagában biológiai (védő) hatást jelent. Az így keletkezett új hidroximetil-transz-rezveratrol származékok antiproliferatív hatást mutatnak (pl. mikrobák és tumor sejtek ellen) (Tyihák et al., 2009).
Anyag és módszer
Vizsgálati anyag:
Méréseinket modell oldatokból, továbbá 2020-ban szüretelt Chardonnay és Kékfrankos mintákból végeztük. Vizsgálatokat végeztünk metil-alkohol tartalomra és galakturonsavra vonatkozóan.
Vizsgálatok modell oldatokból:
Az elméleti megfontolásokat követve elkészítettünk egy 180 g/l koncentrációjú 50-50% glükóz-fruktózból álló oldatot, melynek pH-ját borkősavval 3,3-re állítottuk be, majd 37%-ban észterezett 1 g/l nagytisztaságú pektint mértünk hozzá. Az így kapott „oldatot” 4 részre osztva erjesztettük:
- Spontán
- Az általánosan alkalmazott fajélesztővel beoltva
- Fajélesztő + poligalakturonáz enzim
- Enzim
Az enzimen 99,9 %-os poligalakturonázt értünk. Az ajánlott 2 g/hl (q) adagolásban. Két órás kontaktidőt feltételezve.
Vizsgálatok 2020-ban szüretelt Chardonnay és Kékfrankos mintákból:
- mázsa szőlőt dolgoztunk fel a szokásos borászati technológia szerint a következő kiegészítésekkel:
- bogyózás-zúzás stb., mint kontroll
- bogyózás-zúzás + poligalakturonáz enzim stb.
Kékfrankos esetében ugyanezeket a lépéseket követtük.
Az erjesztéshez a gyakorlatban alkalmazott fajélesztőt használtuk.
Vizsgálati módszer:
A minták metanol koncentrációit az alábbi módszer szerint határoztuk meg:
Shimadzu GC-2030 gázkromatográf FID detektorral. A detektor hőmérséklete 200 °C.
A vivőgáz hélium, 0,97 ml/perc áramlási sebességgel. A kolonna Rtx-5MS Shimadzu kolonna: 30 m, 0,25 mm ID, a film vastagsága 0,25 µm.
A hőmérsékletgradiens 35 °C-ról indul, amit 3 percig tart, majd 30°C/perc sebességgel fel kell menni 170 °C-ra és ott tartani 3 percig.
Az injektor hőmérséklete: 200 °C. A split arány: 300.
A galakturonsavat az általunk speciálisan borra kidolgozott HPLC-s módszerrel határoztuk meg.
Eredmények és értékelés
- Modell oldatok vizsgálati eredményei:
- táblázat: Modell oldatok metil-alkohol és galakturonsav mérésének eredményei
| Metil-alkohol [mg/l] | Galakturonsav [mg/l] | ||
| EK | Kontroll | 45,0 | 0 |
| E1 | Fajélesztő | 621,0 | 0 |
| E2 | Fajélesztő + enzim | 270,0 | 622,0 |
| E3 | Enzim | 46,0 | 690,0 |
A háromszoros ismétlésben elvégzett fenti eredményeket megvizsgálva az alábbiakat állapíthatjuk meg: a spontán erjedésből származóan galakturonsav nem képződött, vagyis pektinbontás nem történt és a képződött metil-alkohol koncentráció alacsony. A fajélesztős beoltás meglepően magas metanol koncentrációt eredményezett, mely tény azt sugallja, hogy a fajélesztő jelentős pektin-metil-észteráz aktivitással rendelkezik. Ezt az aktivitást csökkenti az E2-es és E3-as mintában az extrém koncentrációban alkalmazott galakturonáz enzim, mely jelentős mennyiségben mutat galakturonsav koncentrációt, továbbá a metil-alkohol koncentrációból levonható az a tény, hogy a fajélesztő az, amely a kísérleti mintákban a metil-alkohol koncentráció jelentős mennyiségéért felelős. Új kutatási témaként jelentkezhet a különböző fajélesztők metil-alkohol termelésének vizsgálata! Összességében tehát megállapítható, hogy a galakturonáz enzim aktivitás szükséges növelése a metil-alkohol koncentráció csökkenését eredményezi.
- Félüzemi kísérletek
Chardonnay és Kékfrankos minták vizsgálata:
Ismert tény, hogy a szőlő jelentős pektináz aktivitással rendelkezik, mely tény a szőlőfeldolgozás során kerül előtérbe. A fentebb említett kísérleti munkánkban a szőlőfeldolgozással egy időben adagoltunk galakturonáz enzimet remélve, hogy a modell oldatban nyert eredményeket kapjuk. A kapott eredményeket a 2. táblázat mutatja.
2.táblázat: Chardonnay és Kékfrankos minták metil-alkohol koncentrációi
| Metil-alkohol [mg/l] | |
| Chardonnay kontroll | 37,0 |
| Chardonnay fajélesztővel | 69,0 |
| Chardonnay fajélesztő + poligalakturonáz | 64,0 |
| Kékfrankos kontroll | 70,0 |
| Kékfrankos fajélesztővel | 187,0 |
| Kékfrankos fajélesztő + enzim | 201,0 |
A táblázat eredményeit diszkuttálva megállapítható, hogy a kontrollhoz képest mind a fajélesztő, mind az enzimes kezelés magasabb metil-alkohol koncentrációt eredményezett. Az eredményeket látva úgy tűnik, hogy a fajélesztő hatása az ajánlott enzimkoncentrációkat figyelembe véve felülmúlja a galakturonáz aktivitást.
A félüzemi kísérletet laboratóriumi körülmények között megismételtük. Egy-egy kilogramm Kékfrankos (2020-as évjárat) bogyóit zúztuk, majd az egyik felét a fentiek szerint enzimes kezelésnek vetettük alá. Kierjedés után mértük a kapott bor metil-alkohol koncentrációját. Az alábbi eredmények adódtak.
- táblázat: Kierjedés utáni metanol koncentrációk
| Metil-alkohol [mg/l] | |
| Kontroll | 142,0 |
| Enzimes | 205,0 |
A modell oldatban nyert tapasztalataink, miszerint az enzimes kezelés – amennyiben tiszta poligalakturonáz enzimkészítményről van szó – csökkenti a végtermék metil-alkohol koncentrációját nem igazolódott vissza, sőt azt tapasztaltuk, hogy az enzimes kezelés, amely egyéb bortechnológiai szempontból fontos lépés a metanol koncentráció növekedését eredményezi azzal, hogy abszolút értelemben ez a koncentráció messze nem okoz egészségkárosító hatást. Erre vonatkozóan további kísérleteket érdemes folytatnunk.
- Célzott vizsgálatok:
Napjainkban a piaci kihívások egy sor alternatív bortípust kreálnak (narancsbor, biobor, vegán bor stb.), amelyek mind a szokásos borászati technológia mellőzésével készülnek, ezáltal elméletileg teret biztosítanak azoknak a természetes körülmények között jelenlévő enzimeknek, amelyek például a metanol koncentrációjának növekedését eredményezhetik. Ebből a célból néhány direkttermő, néhány bio, illetve néhány narancsbor koncentrációját közöljük tájékoztató jelleggel.
4.táblázat: Célzott vizsgálatok metanol koncentrációi
| Metil-alkohol [mg/l] | |
| Otello 1 | 120,0 |
| Otello 2 | 187,0 |
| Otello 3 | 255,0 |
| Otello 4 | 188,0 |
| Noah | 101,0 |
| Direkttermő rozé | 118,0 |
| Direkttermő rozé (almasavbontott) | 124,0 |
| Direkttermő vörös kontroll | 290,0 |
| Direkttermő vörös (almsavbontott) | 310,0 |
| Narancsbor 1 | 53,0 |
| Narancsbor 2 | 67,0 |
A fenti adatokat értékelve megállapítható, hogy az eddigi ismereteket alátámasztandóan a direkttermők metanol koncentrációja az átlagoshoz képest magasabb. A közölt adatokon túli számos vizsgálat alapján is aláhúzhatjuk, hogy a biológiai almasavbontás metanol koncentráció növekedéssel jár. Az új típusú borok metil-alkohol koncentrációja a szokásos, problémát nem okoz. Azok a borok, amelyek ma a piacon forgalomban vannak metanol szempontjából nem támadhatóak. Ez a megállapítás egyértelműen vonatkozik az alternatív bortípusokra, továbbá a direkttermőkre, noha azok piaci forgalmazása jelenleg tiltott.
KÖVETKEZTETÉSEK
A jelenlegi publikációnkban a borok metanol koncentrációival foglalkoztunk. Érintettük azokat a borkészítés során lejátszódó folyamatokat, melyek metanolképződést eredményeznek. Kísérleteket folytattunk arra vonatkozóan, hogy az egyébként nem mérgező koncentrációban jelen lévő metanol mennyiségét csökkentsük. Kísérleti eredményeink bíztatóak, de nem igazolták vissza egyértelműen azt a feltételezésünket, mely szerint a galakturonáz enzim koncentrációjának eltolása a metanol koncentrációjának csökkenését eredményezné. A fajélesztők metil-alkohol képzésére, valamint az előbbi feltevésre vonatkozóan további kísérletek elvégzése szükséges.
FELHASZNÁLT IRODALOM
- Bekatorou, A. 2016: Alcohol: Properties and determination. Encyclopedia of Food and Health. Academic Press, Oxford, pp 88–96. https://doi.org/10.1016/B978-0-12-384947-2.00017-9
- Chaiyasut C., Jantavong S., Kruatama C., Peerajan S., Sirilum S., Shank L. (2013): Factors affecting methanol content of fermented plant beverage containing Morinda citrifolia. African Journal of Biotechnology. 12(27):4356–4363. doi: 10.5897/AJB10.1377.
- Donald G., Barceloux G., Randall Bond, Edward P. Krenzelok, Cooper H., Allister J. V. 2002: American Academy of Clinical Toxicology Practice Guidelines on the Treatment of Methanol Poisoning. Journal of Toxicology: Clinical Toxicology, 40(4), 415–446; https://doi.org/10.1081/CLT-120006745
- Dorokhov Y.L., Shindyapina A.V., Sheshukova E.V., Komarova T.V. 2015: Metabolic methanol: molecular pathways and physiological roles. Physiological Reviews, 95:603–644. doi: 10.1152/physrev.00034.2014.
- Hodson G., Wilkes E., Azevedo S., Battaglene T. 2017: Web of Conferences 9, 02028; doi: 10.1051/bioconf/20170902028 40th World Congress of Vine and Wine
- Jacobsen D., McMartin K.E. 1997: Antidotes for methanol and ethylene glycol poisoning. British Journal of ClinicalPharmacology; 35:127-143
- Lal J., Kumar C.V., Suresh M.V., Indira M., Vijayammal P.L. 2001: Effect of exposure to country liquor (toddy) during gestation on lipid metabolism in rats. Plant foods for human nutrition. 56:133–43.
- Litovitz T.L., Klein-Schwartz W., Caravati E.M., Youniss J., Crouch B., Lee S. 1999: 1998 annual report of the American Association of Poison Control Centers Toxic Exposure Surveillance System. American journal of emergency medicine. 17 (5):435-487; doi: 10.1016/s0735-6757(99)90254-1.
- Micheli F. 2001: Pectin methylesterases: cell wall enzymes with important roles in plant physiology. Trends in plant science. 6 (9):414–419. doi: 10.1016/S1360-1385(01)02045-3.
- Mojsov K., Andronikov D., Janevski, A., Jordeva S., Zezova S. 2015: Enzymes and wine—The enhanced quality and yield. Advanced Technologies. 4(1): 94–100.
- Ohimain E.I. 2016: Methanol contamination in traditionally fermented alcoholic beverages: the microbial dimension. Springer Plus. 5(1): 1607; doi:10.1186/s40064-016-3303-1.
- Paine A., Davan A.D. 2011: Defining a tolerable concentration of methanol in alcoholic drinks. Human and experimental toxicology. 20(11):563–568. doi: 10.1191/096032701718620864.
- Schink B., Zeikus J.G. 1980: Microbial methanol formation: a major end product of pectin metabolism. Current Microbiology. 4:387–389. doi: 10.1007/BF02605383.
- Sieiro C., Garcia-Fragna B., Lopez-Seijas J. 2012: Microbial pectic enzymes in the food and wine industry. Food Industrial Processes- Methods and Equipment. pp. 201–218.
- Siragusa R.J., Cerda J.J., Baig M.M., Burgin C.W., Robbins F.L. 1988: Methanol production from the degradation of pectin by human colonic bacteria. American Journal of Clinical Nutrition. 47(5):848–851.
- Tyihák E., Horváth E., Kátay Gy., Királyné Véghely Zs., Mincsovics, E. 2009: A transz-rezveratrol és rokonvegyületek vizsgálata BioAréna-rendszerben. Munkabeszámoló. OTKA.
- Zoecklein B. W., Fugelsang K. C., Gump B. H., Nury F. S. 1995: Wine Analysis and Production, Chapman and Hall, New York, pp.107.
- Internetes hivatkozás: Pektinbontó enzimek, 2009: http://enfo.agt.bme.hu/drupal/node/11694)
1Nyitrainé dr. Sárdy Diána – 2Antal Eszter– 3 dr. Kállay Miklós- 4Matolcsi Réka
1 Szent István Egyetem, Kertészettudományi Kar, Borászati Tanszék; 1118 Budapest, Ménesi út 45.,kertesz.dekan@kertk.szie.hu
2 Diagnosticum Zrt; 1047 Budapest, Attila u. 126., eszter@diagnosticum.hu
3Szent István Egyetem, Kertészettudományi Kar, Borászati Tanszék; 1118 Budapest, Ménesi út 45., kallay.miklos@kertk.szie.hu
4 4Szent István Egyetem, Kertészettudományi Kar, Borászati Tanszék; 1118 Budapest, Ménesi út 45., matolcsi.reka@diagnosticum.hu